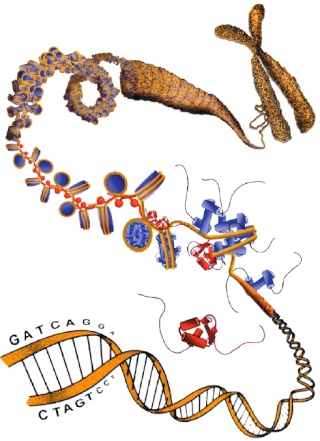
Épigénétique
Étymologie
Composé de épi- (« au-dessus ») et génétique.
Définition
Relatif à l’influence de l’environnement sur l’expression des gènes.
« C'est un concept qui dément en partie la "fatalité" des gènes. »
« Contrairement à l’hérédité génétique, un statut épigénétique peut généralement être inversé ; par exemple, les chromosomes X sont réactivés avant la formation des gamètes.»
Introduction : épigénétique et troubles mentaux
Depuis 2004, la découverte de l'épigénétique renverse toutes les théories habituelles et les idées reçues sur l'origine des "troubles mentaux". Ils ne sont, et il faut sans cesse le répéter, ni totalement héréditaires ou "génétiques" comme le voudraient nombre de biologistes et médecins, ni entièrement psychologiques et issus d'entités abstraites et de refoulements obscurs comme le voudraient les psychanalystes, mais bio-psycho-sociaux, comme le pressentent les intéressés qui étudient leur "trouble", et les bon praticiens qui parlent de "vulnérabilité naturelle favorisant le fait que les évènements ou l'environnement vont plus facilement déclencher tel ou tel trouble". La science donne manifestement des arguments supplémentaires à ces derniers, avec les découvertes de l'épigénétique. L'article publié en France par Sciences et Vie a bientôt 6 ans mais synthétise bien l'essentiel, et a été repris de multiples fois. Une de plus ne fera pas de mal...
Nos états d’âme modifient notre ADN
d'après Science et Vie, mars 2010
Introduction
A contre-pied du déterminisme implacable du "tout-génétique", de nombreux chercheurs constatent aujourd’hui que nos expériences, nos émotions, nos actions façonnent l’expression de nos gènes en permanence. Si l’on sait depuis longtemps que le stress et les traumatismes psychiques influent à la fois sur les comportements et sur la santé, les récents travaux montrent qu’ils attaquent directement l’ADN.
Une multitude d’études cliniques ont confirmé les théories de Sigmund Freud : ceux qui ont subi de grands traumatismes dans l’enfance sont globalement plus sujets à la dépression, à la toxicomanie, aux comportements asociaux, mais aussi à l’obésité, au diabète et aux maladies cardiovasculaires. Ce mal-être s’ancre parfois en nous, avant la naissance. En effet, d’autres études montrent que les enfants dont la mère a subi un stress psychologique prolongé ou un traumatisme psychique intense pendant la grossesse ont plus de risques que les autres d’être anxieux, dépressifs, voire schizophrènes.
Revenir au sommaire
2004 - Les découvertes d'Elizabeth Blackburn (prix Nobel 2009) et Elissa Epel
Le secret de cette empreinte biologique serait niché au cœur de nos cellules, là où les effets du stress perturbent l’organisme en s’attaquant à l’ADN. Cela a été démontré en 2004 par la biologiste australo-américaine Elisabeth Blackburn (pris Nobel de médecine en 2009), et Elissa Epel, psychiatre à l’université de Californie, en comparant l’ADN de mères d’enfants en bonne santé à celui de mères d’enfants atteints d’une maladie grave et chronique comme l’autisme ou un handicap moteur et cérébral. Chez ces dernières, soumises au stress psychologique chronique, l’ADN présente des signes de vieillissement précoce ...
Plus précisément, c’est l’extrémité des chromosomes qui est atteinte. En effet, au cœur des cellules, l’ADN est condensé sous forme de chromosomes, à l’extrémité desquels se trouvent des « capuchons » appelés télomères qui les protègent de l’érosion au fil des divisions cellulaires. Cependant, ils raccourcissent progressivement au fur et à mesure que la cellule vieillit. Or, chez ces mères angoissées, les télomères sont anormalement courts, reflétant un vieillissement accéléré de 9 à 17 ans !
« Nous observons ainsi un lien direct entre les émotions et ce qui se passe dans la cellule », précise Elissa Epel. « Et nous avons aussi constaté que lorsque le niveau de stress diminue, la longueur des télomères augmente ! »
Stress et traumatismes psychiques entraînent des erreurs d’étiquetage épigénétique dans la zone cérébrale qui gère les émotions, l'hippocampe
L’état de stress inscrit sa marque directement sur nos gènes, modifiant de façon ciblée et durable certains de nos comportements. Cette action relève d’un phénomène biologique dont l’importance se dévoile de plus en plus aujourd’hui : l’épigénétique, terme désignant les modifications chimiques qui affectent l’ADN, autres que les mutations qui touchent la structure même de la molécule. Ces modifications épigénétiques sont comme de petites « étiquettes » - des groupements méthyles - qui indiquent à la machinerie cellulaire quels gènes elle doit utiliser ou, au contraire, ignorer. A la clé, la méthylation empêche physiquement l’expression des gènes en se plaçant sur l’ADN.
Ainsi, un choc psychique ou un stress chronique peuvent déclencher un phénomène chimique de méthylation. Marqués par des molécules de méthyles, certains gènes ne sont plus transcrits en ARN. Le problème est que ce sont souvent des régulateurs du stress.
Or, les biologistes constatent que stress et traumatismes psychiques entraînent des erreurs d’étiquetage épigénétique dans la zone cérébrale qui gère les émotions, l’hippocampe.
Revenir au sommaire
 Elizabeth Blackburn, Prix Nobel 2009
Elizabeth Blackburn, Prix Nobel 2009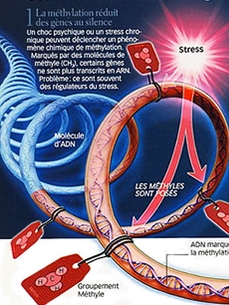 Le stress et les traumatismes provoquent des méthylations des télomères, bloquant l'émission d'ARN. Image : Sciences & Vie
Le stress et les traumatismes provoquent des méthylations des télomères, bloquant l'émission d'ARN. Image : Sciences & Vie2004 - Michael Meaney et son équipe démontrent les effets du stress sur l'hippocampe de rats
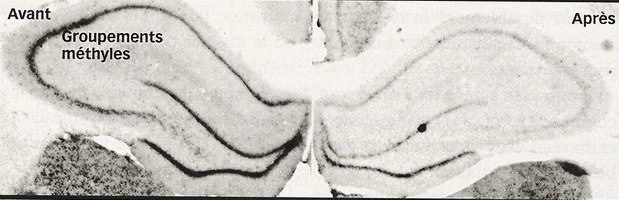
Méthylation de l'hippocampe de rats (à gauche) due au stress.
Une équipe menée par Michael Meaney, à l’université McGill (Canada), l’a montré en 2004 en comparant le cerveau de bébés rats cajolés par leur mère à ceux de ratons délaissés.
Le délaissement induit des modifications épigénétiques qui bloquent le gène utilisé pour produire le récepteur aux corticoïdes dans l’hippocampe. Or, ce récepteur contrôle la réponse au stress. En clair, les rats délaissés possèdent moins de récepteurs au cortisol, et sont alors moins armés pour faire face au stress. Perpétuellement angoissés, ils souffrent de troubles de la mémoire et d’un comportement dépressif. Même à l’âge adulte, le moindre dérangement prend chez eux des proportions alarmantes ...Selon les chercheurs, ce résultat peut être extrapolé à l’homme (selon une étude menée en mars 2009).
Depuis 2008, les études qui confirment le rôle de l’environnement et du vécu dans l’apparition des troubles mentaux se multiplient.
Depuis 2008 on découvre régulièrement des liens entre l'épigénétique et les troubles mentaux
Depuis 2008, les études qui confirment le rôle de l’environnement et du vécu dans l’apparition des troubles mentaux se multiplient. Des chercheurs canadiens du Centre de l’addiction et de la santé mentale, à Toronto, ont comparé le cerveau de personnes atteintes de schizophrénie ou de troubles bipolaires à celui de témoins. Chez les premières, 40 gènes présentaient une méthylation anormale. Or, ces gènes s’avèrent pour la plupart impliqués dans le développement cérébral ou la transmission des messages entre les neurones.
Certes, les scientifiques sont encore loin de pouvoir faire la part du biologique dans les maladies psychiatriques. Mais certaines données sont troublantes : c’est parfois en remontant très loin dans l’histoire d’un individu, avant sa naissance, que l’on trouve la « source » de la maladie.
Ainsi, en 2008 également, une étude danoise menée sur 1,38 million de femmes a montré que le fait d’être confronté à la maladie ou au décès d’un proche juste avant ou pendant la grossesse augmente de 67% le risque de schizophrénie chez l’enfant à naître.
En outre, lorsqu’une femme est dépressive ou anxieuse pendant sa grossesse, le bébé a tendance a présenter un marquage épigénétique anormal sur le gène du récepteur aux corticoïdes. Avec pour conséquence un nourrisson aux taux de cortisol élevé, très sensible au stress. La preuve que nos gènes gardent la cicatrice des événements vécus avant même la naissance !
« Je pense que la plupart des maladies chroniques comme l’asthme, le cancer, le diabète, l’obésité, les maladies neurologiques (autisme, troubles bipolaires, schizophrénie), résulte en partie d’une mauvaise régulation épigénétique lors des premiers stades de développement », estime Randy Jirtle, directeur du laboratoire d’épigénétique à la Duke University, aux Etats Unis.
Alors que le génome d’un individu reste très stable au cours de sa vie, l’ensemble des marques épigénétiques qui régulent l’expression des gènes - son « épigénome » - varie constamment, en réaction aux variations extérieures. Et c’est justement son rôle : « L’épigénome est une interface entre nos gènes, qui sont statiques, et notre environnement, variable », explique Randy Jirtle. Ainsi, la « partition » génétique reste la même, mais son interprétation peut varier au cours de la vie, en fonction de son marquage épigénétique.
Revenir au sommaire
2009 - Le marquage épigénétique réversible
Si le marquage épigénétique est dynamique, l’expérience de chercheurs de l’université Rockefeller à New York laisse penser que ce marquage serait réversible. Ils ont réussi en 2009 à « annuler » les effets épigénétiques causés par le stress dans le cerveau de souriceaux en leur donnant du Prozac, un antidépresseur (1). Mieux, la trichostatine A, un médicament proche du valproate, utilisé pour réguler les troubles de l’humeur dans certaines psychoses, a permis de supprimer le marquage épigénétique anormal et de corriger le comportement de rats adultes ayant été négligés par leur mère à la naissance.
En outre, les émotions positives peuvent heureusement, elles aussi, laisser leur empreinte. En 2008, des travaux menés au Massachussetts General Hospital ont montré que huit semaines de relaxation suffisaient à modifier l’expression de plusieurs centaines de gènes, selon un profil totalement opposé à celui induit par le stress. Par ailleurs, une étude menée à l’université de Saarland, à Hambourg, a montré que l’activité physique ralentit le raccourcissement des télomères dans les globules blancs. De son côté, Elissa Epel a lancé une étude pour étudier les effets de la méditation sur la longueur des télomères.
« En fait, le message de l’épigénétique est optimiste. Ses empreintes peuvent être inversées, et nous cherchons maintenant à utiliser des médicaments agissant sur ce marquage pour soigner les maladies mentales », explique Moshe Szyf.
« Il y a aussi des chances pour que le soutien social et psychologique suffise à corriger le marquage épigénétique chez les personnes à risque. »
Ainsi, contrairement à ce qu’affirmaient les scientifiques dans les années 1990, nous ne sommes pas uniquement le produit de nos gènes. Nos expériences, nos émotions, nos actions, façonnent l’expression de ces gènes en permanence. Avec la certitude que rien n’est irrémédiable.
1. Dans l'étude de Richard Hunter, il est relevé seulement certains effets modérés, sur certaines méthylations. R.H conclut qu'il y a là une "avenue de recherche", ce que d'autres interprètent un peu vite comme un "effet bénéfique".
2. Rien ne permet dans cette étude, d'attribuer un effet direct à l'antidépresseur. En effet, seul un lien statistique a été montré, limité à un seul type d'action épigénétique, et au seul cas du "stress modéré chronique" consistant à restreindre la nourriture de rats pendant 21 jours. Il est possible que l'effet soit clairement indirect - au même titre que l'activité physique, la relaxation ou le retour de la nourriture - par l'augmentation des niveaux de sérotonine établi par ailleurs.
3. L'épigénétique des antidépresseurs se traduit aussi par des effets indésirables, ce que d'autres études sembleraient aussi démontrer : "La fluoxétine, prise de manière chronique, provoque une désensibilisation persistante des récepteurs 5HT1A même après l'arrêt du traitement l'ISRS. Certains de ces changements d'expression génique sont le résultat d'une structure ADN altérée provoqué par le remodelage de la chromatine. L'utilisation chronique d'antidépresseurs peut causer une expression altérée et persistante de gène cérébral conduisant à une neurotransmission catécholaminergique altérée, et des perturbations neuroendocrines telles que la diminution des taux de testostérone, une fertilité réduite et une dysfonction sexuelle persistante."
Source : Csoka AB, Szyf M., « Epigenetic side-effects of common pharmaceuticals: a potential new field in medicine and pharmacology. », Med Hypotheses. 2009 Nov;
Revenir au sommaire
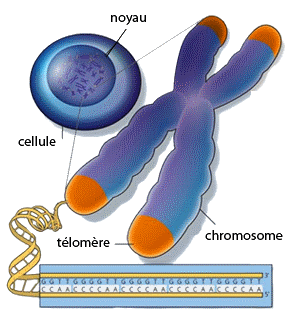
Les télomères. Source : Université de Liège, site de vulgarisation
 "Épigénétique : ajouter les détails manquants". Les 4 programmes lancés en 2011 par l'Université de recherche en Santé du Canada, dont 3 concernent les troubles et handicaps mentaux
"Épigénétique : ajouter les détails manquants". Les 4 programmes lancés en 2011 par l'Université de recherche en Santé du Canada, dont 3 concernent les troubles et handicaps mentaux Elissa Eppel, pionnière de l'épigénétique, étudie, entre autres, les effets de la méditation sur l'état des télomères
Elissa Eppel, pionnière de l'épigénétique, étudie, entre autres, les effets de la méditation sur l'état des télomères La méthylations des télomères est réversible : méditation, sport, médicaments restituent l'émission d'ARN. Image : Sciences & Vie
La méthylations des télomères est réversible : méditation, sport, médicaments restituent l'émission d'ARN. Image : Sciences & Vie